本文率
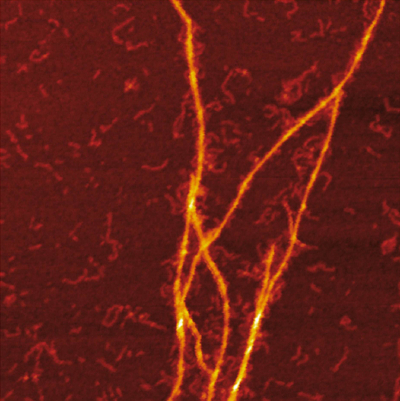
研究团队领导,柳德米拉Morozova Umea大学的罗氏公司,瑞典,提供了机械的见解蛋白质co-aggregation阿尔茨海默氏症。S100A9淀粉的模板机制Aβco-aggregation过程中纤维表面显示了协同作用的生物物理方法包括电荷检测质谱,显微镜,动力学和微流控分析。
淀粉样蛋白的形成是重要的临床意义,因为这个过程涉及许多神经退行性疾病如阿尔茨海默氏症,帕金森氏症和其他人。这些疾病影响数以百万计的全球老龄化。通常很难画出这些疾病之间或他们可能同时发生,这被称为疾病发病率。
广泛而淀粉样蛋白形成过程进行了研究,对co-aggregation不同的淀粉样蛋白的具体机制物种在一起,潜在的疾病的发病率。在阿尔茨海默病,amyloid-neuroinflammatory级联是表现在co-aggregation Aβ的促炎S100A9蛋白质,导致细胞内和细胞外的淀粉样蛋白组装、淀粉样斑块口供和细胞毒性。
破译促炎S100A9蛋白质和Aβ之间的交互42肽在阿尔茨海默病是根本,因为炎症疾病发病中起着重要的作用。研究人员使用电荷检测质谱(CDMS)与生物物理技术来提供机械的见解co-aggregation过程和区分淀粉样蛋白复合物在单粒子水平。淀粉的质量和电荷分布组合一起重建它们之间的区别和详细的显微镜显示,co-aggregation涉及模板AβS100A9纤维表面上的42淀粉。动力学分析进一步证实,Aβ可用的表面42二次成核减少是由于涂层S100A9淀粉,而绑定S100A9 Aβ42纤维是由一个微流控分析验证。研究人员表明,探测器之间的协同作用,显微镜,动力学和微流控分析打开跨学科研究的新方向。
这项工作发表在化学科学。
本文率
技术











