手术切除肿瘤仍然是癌症治疗中最常见的手术之一,大约45%的癌症患者在某个时候接受了手术切除肿瘤。由于最近成像和生化技术的进步,外科医生现在能够更好地区分肿瘤和健康组织。具体来说,这是通过荧光引导手术(FGS)实现的。
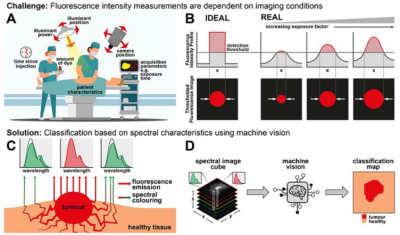
在FGS中,患者的组织用一种染料染色,当用特殊光源照射时,这种染料会发出红外(IR)光。这种染料优先与肿瘤细胞表面结合,因此它的光波发射可以提供肿瘤位置和范围的信息。在大多数基于fgs的方法中,红外发射的绝对强度被用作识别肿瘤对应像素的主要标准。然而,事实证明,这种强度对光照条件、相机设置、染料用量和染色后的时间很敏感。因此,基于强度的分类容易产生错误的解释。
但是如果我们可以使用强度无关的方法来分类健康细胞和肿瘤细胞呢?最近,英国伦敦大学学院的Dale J. Waterhouse领导的一项研究提出了这样一种方法。研究团队开发了一种新技术,将机器学习与短波红外(SWIR)荧光成像相结合,以检测肿瘤的精确边界。
他们的方法依赖于捕获染色组织的多光谱SWIR图像,而不是简单地测量一个特定波长的总强度。简单地说,该团队在他们的SWIR光学系统前依次放置了六个不同波长的频率滤波器,并为每个像素登记了六个测量值。这使得研究人员能够为每种类型的像素(背景、健康或肿瘤)创建光谱剖面。接下来,他们训练了7个机器学习模型来准确地识别多光谱SWIR图像中的这些特征。
研究人员训练并验证了这些模型在活的有机体内使用SWIR图像和实验室模型诊断侵袭性成神经细胞瘤。他们还比较了不同的归一化方法,旨在使像素的分类独立于绝对强度,这样它只受像素的光谱轮廓的控制。
在七个测试模型中,表现最好的模型实现了97.5%的像素分类精度(肿瘤、健康和背景像素的精度分别为97.1%、93.5%和99.2%)。此外,由于光谱剖面的归一化,模型的结果对成像条件的变化更加稳健。这对于临床应用来说是一个特别理想的特性,因为通常测试新成像技术的理想条件并不能代表真实的临床环境。
基于他们的发现,该团队对所提出的方法寄予厚望。他们预计,在人类患者中实施的试点研究可能有助于彻底改变FGS领域。此外,多光谱FGS可以扩展到超出目前研究范围的范围。例如,它可以用来从图像中去除手术或背景光,去除不必要的反射,并提供非侵入性的方法来测量脂质含量和氧饱和度。此外,多光谱系统可以同时使用具有不同发射特性的多种荧光染料,因为来自每种染料的信号可以根据其光谱轮廓从总测量中分离出来。这些多种染料可以用于针对疾病的多个方面,为外科医生提供更多的信息。












