本文率
在一系列复杂的实验中,康斯坦茨大学的化学家研究的影响是改变一个氨基酸的α-突触核蛋白的蛋白质。他们能够证明这个smallchange扰乱膜α-突触核蛋白的绑定。“我们希望这个选择性膜缺陷的发现绑定将帮助我们了解帕金森在分子水平上的发展。最终,这将促进治疗策略”的设计,概述了茱莉亚Cattani博士生。研究结果显示美国化学学会杂志》上。
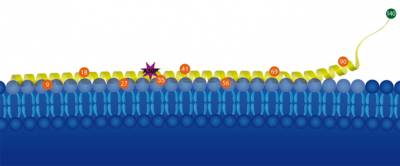
人类的大脑含有大量蛋白质的α-突触核蛋白。它的确切生物学功能仍是未知,但它与帕金森病密切相关;蛋白质的“聚合”帕金森病人的神经细胞。α-突触核蛋白由140个氨基酸链。在极少数情况下帕金森病遗传;这发生的140组件所取代。马尔特Drescher和他的工作小组在康斯坦茨大学化学系已经发现这些影响选择性的蛋白质序列的变化对α-突触核蛋白的行为。“我们可以表明,选择性突变干扰细胞膜结合α-突触核蛋白在地方层面”,Malte Drescher解释道。
找出更多关于选择性突变的影响,Konstanz-based化学家Marta Robotta博士和茱莉亚Cattani应用磁探针分子的不同位置将α-突触核蛋白的蛋白质。电子顺磁共振光谱的帮助下,研究人员能够衡量这些nanomagnets的旋转。半岛综合体育官方APP下载德甲在每一个残留的α-突触核蛋白结合膜,自转减慢。这样他们能够找到准确的时间和地点的绑定膜不辎重。氨基酸的交换他们发现膜的扰动绑定alpha-synuclein-an重要线索的帕金森病的分子。
“我们竭尽全力,执行超过200光谱实验中,我们的结果与我们的模型通过专门研制的仿真算法。结果当然补偿我们的努力”,茱莉亚Cattani说。
本文率

